问题描述:
某化学小组在实验室制取Na2O2.查阅资料可知:钠与空气在453~473K之间可生成Na2O,迅速提高温度到573~673K之间可生成Na2O2,若温度提高到733~873K之间Na2O2可分解.除Li外其他碱金属不与N2反应.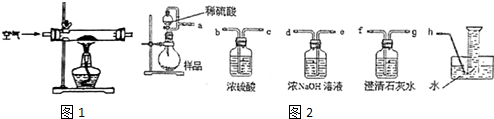
(1)甲组设计制取Na2O2装置如1图.
①使用该装置制取的Na2O2中可能含有的杂质为___.
a.Na3N b.Na2CO3 c.Na2Od.NaOH e.NaHCO3
②该小组为测定制得的Na2O2样品的纯度,设计装置如图2:
烧瓶中发生的主要反应的化学方程式是___.分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果___(填“偏大”、“偏小”或“无影响”).测定装置的接口从左至右正确的连接顺序是___.
(2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果___(填“偏大”或“偏小”).为证明其分析的正确性,设计实验方案如下:
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
(3)丙组根据上述提供的有关信息,设计一个方案可准确的测定样品的纯度.请简述实验操作和需要测定的有关数据___.
(1)①钠与氧气反应可以得到氧化钠、过氧化钠,二者均与二氧化碳反应得到碳酸钠,与水反应会得到氢氧化钠,由信息可知钠与氮气不反应,而碳酸氢钠受热分解,Na2O2中可能含有的杂质为Na2CO3、Na2O、NaOH,
故答案为:bcd;
②烧瓶中过氧化钠与硫酸反应生成硫酸钠、氧气与水,反应方程式为:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,
分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,还可以抵消滴加硫酸排出空气的体积,若没有该导管,排出的空气按生成氧气的体积计算,导致测定氧气体积偏大,则测定Na2O2样品的纯度偏大,
用浓氢氧化钠溶液吸收可能氧气中混有二氧化碳,澄清石灰水检验二氧化碳是否除尽,用排水法收集氧气,根据氧气体积可以计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数,测定装置的接口从左至右正确的连接顺序是aedfgh,
故答案为:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O;偏大;aedfgh;
(2)实验I说明中间产物为过氧化氢,且过氧化氢没有完全分解为氧气,导致测定氧气体积偏小,从而导致测定结果偏小;
实验Ⅱ:反应后的溶液中有硫酸剩余,可以使红色酚酞溶液褪色;
实验Ⅲ:加入的氢氧化钠先中和剩余的硫酸,过量的氢氧化钠式溶液显红色,过氧化氢具有强氧化性,又使溶液红色褪去,反应溶液中存在的中间产物与酚酞作用的条件是碱性条件,
故答案为:偏小;I;碱性条件;
(3)称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.]
故答案为:称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.].

