问题描述:
固体粉末甲由FeSO4、Fe2(SO4)3、CuSO4、CaCO3、SiO2、NaCl中的若干种组成,取一定量的固体甲进行如下实验: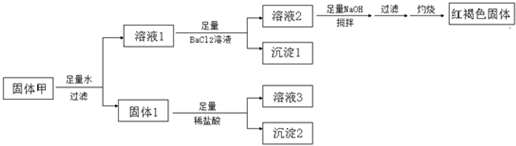
固体1质量为11g,沉淀1质量为23.3g,沉淀2质量为6g,红褐色固体质量为8g.则下列说法正确的是( )
A. 溶液1加入KSCN溶液一定呈红色
B. 取少量溶液2加入酸化的硝酸银溶液,生成白色沉淀,则甲中一定有NaCl
C. 固体1与稀盐酸反应时还生成了标准状况下气体1.12L
D. 沉淀2不溶于任何酸溶液
FeSO4、Fe2(SO4)3、CuSO4、CaCO3、SiO2、NaCl中CaCO3、SiO2不溶于水,加入盐酸,CaCO3溶解,可知m(SiO2)=6g,m(CaCO3)=11g-6g=5g,溶液1加入足量氯化钡生成沉淀1为硫酸钡沉淀,溶液2加入足量氢氧化钠溶液最终得到红褐色固体,红褐色固体为氢氧化铁,可知含有FeSO4、Fe2(SO4)3中的至少一种,不含CuSO4,
A.如只含有FeSO4,则加入KSCN溶液不变色,故A错误;
B.因加入氯化钡,引入氯离子,不能确定原固体是否含有氯化钠,故B错误;
C.由以上分析可知固体1中含有5gCaCO3,n(CaCO3)=
| 5g |
| 100g/mol |
D.沉淀2为二氧化硅,可溶于氢氟酸,故D错误.
故选C.

